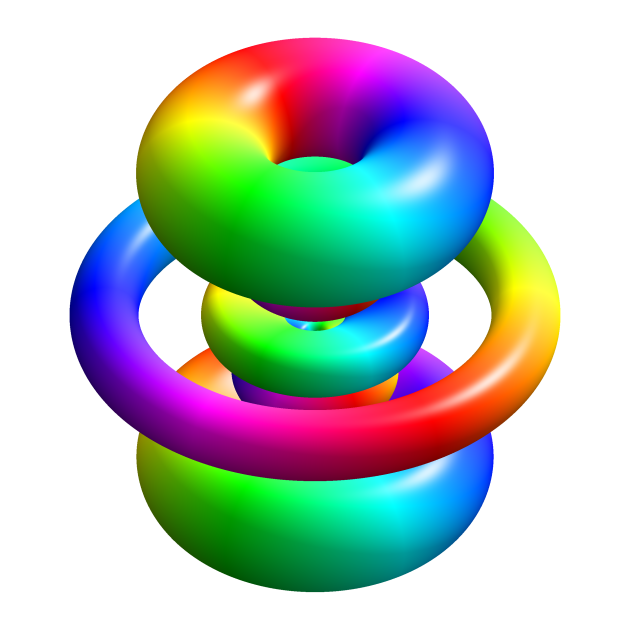
Même si l’on représente usuellement un atome comme un système “solaire”, sa représentation quantique par orbitales (ci-dessus) est bien plus réaliste (Ph. Geek3 via Wikicommons CC BY-SA 3.0
Au vrai, la question se poserait si la structure de l’atome correspondait à celle qu’avançait en 1911 le découvreur du noyau atomique, Ernest Rutherford. Le physicien anglais proposait de considérer l’atome comme un système solaire miniature avec le noyau au centre, les électrons en orbite et la force électromagnétique jouant le rôle de la gravité. Ici, les électrons seraient maintenus en orbite circulaire grâce à l’équilibre entre force centrifuge, qui tend à les éloigner du noyau, et force électromagnétique, qui les attire vers le noyau.
Mais dans ce modèle, rien n’interdit à l’électron de ralentir au point d’entrer en collision avec l’un des protons du noyau. De la même façon que si la Terre ralentit, elle finira par entrer en collision avec le Soleil. Sauf qu’il y a un souci : s’il en était ainsi, les atomes n’étant pas stables, nous ne serions pas là pour en discuter !
Il y a des niveaux d’énergie minimum pour les électrons des atomes
Le modèle planétaire de Rutherford n’est donc pas suffisant pour rendre compte de la réalité de l’atome. Relevant d’une conception classique de la physique, il ne tient pas compte des phénomènes quantiques, comme le fait que l’énergie, la vitesse et la trajectoire d’un électron dans un atome sont des paramètres quantifiés qui ne peuvent pas prendre n’importe quelle valeur.

Avant le modèle “solaire” de Rutherford, J.J. Thomson a imaginé un volume sphérique chargé positivement dans lequel s’agitent des électrons chargés négativement (Domaine public)
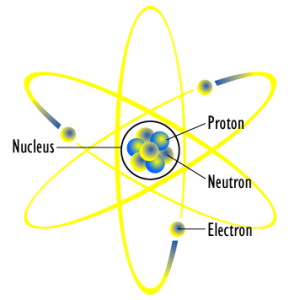
Selon Rutherford, l’atome est structuré comme un système “solaire” (Ph. Fastfission via Wikicommons CC BY-SA 3.0)
Il existe ainsi un niveau d’énergie minimum, qualifié de fondamental, en deçà duquel l’électron ne peut descendre. Ce niveau est associé à une vitesse précise et à une orbite bien définie qui déterminent la trajectoire la plus proche du noyau que l’électron peut espérer suivre – et ce n’est pas une trajectoire de collision.
La bonne solution : le modèle quantique à “orbitales” de Schrödinger
C’est Niels Bohr, physicien danois, qui introduisit, en 1913, la quantification des niveaux d’énergie dans le modèle planétaire de l’atome. Reste que, même ainsi amendé, ce modèle n’est pas totalement satisfaisant. Car parler de trajectoire pour rendre compte des déplacements de l’électron supposerait que l’on sache où il se trouve à chaque instant.
Selon Bohr, les orbites des électrons sont délimitées par des niveaux d’énergie discrets (Ph. Tankist-777 via Wikicommons CC BY-SA 3.0)
Or, on ne peut connaître que la probabilité qu’il occupe telle ou telle région de l’espace autour du noyau : ce sont les orbitales.

Selon Schrödinger, les électrons forment des “orbitales” diffuses : un électron occupe tout le volume de l’orbitale (Ph. HAtomOrbitals via Wikicommons CC BY-SA 3.0 )

Chronologie des 4 modèles atomiques : Thomson, Rutherford, Bohr et Schrödinger (Ph. Scientia via Wikicommons CC BY 3.0)
Ainsi, à chaque niveau d’énergie correspond une orbitale de forme et d’extension différentes. Celle du niveau fondamental est une sphère centrée sur le noyau. Lorsqu’il est dans ce niveau d’énergie minimale, l’électron peut être n’importe où à l’intérieur de cette sphère – y compris dans le noyau !
E.H.
D’après S&V n°1111
> Lire également :
- Sait-on combien il y a d’atomes dans l’Univers ?
- Le nombre d’éléments chimiques est-il limité ?
- On sait enfin combien pèse exactement 1 kilogramme !
- Pourquoi le photon n’a pas de masse et juste une énergie ?
> Lire aussi dans les Grandes Archives de Science & Vie :
- Tableau de Mendeleïev, l’élément 117 met fin au mythe – S&V n°1163 – 2014. Après avoir réussi la synthèse de l’élément chimique 117 (nombre de protons) puis 118, les physiciens se demandent si la longue recherche pour compléter et élargir la tableau de Mendeleïev n’est pas définitivement close… Certains parient que non.
- Alchimie nucléaire : transmutations qui défient les lois – S&V n°1040 – 2004. Transmuter le plomb en or sur sa paillasse, telle était le rêve des alchimistes. Mais encore au XXIe siècle, certains physiciens se demandent s’il ne serait pas possible de transformer des éléments chimiques en d’autres avec les moyens de la chimie, c’est-à-dire sans faire appel à la technologie des très hautes énergies.