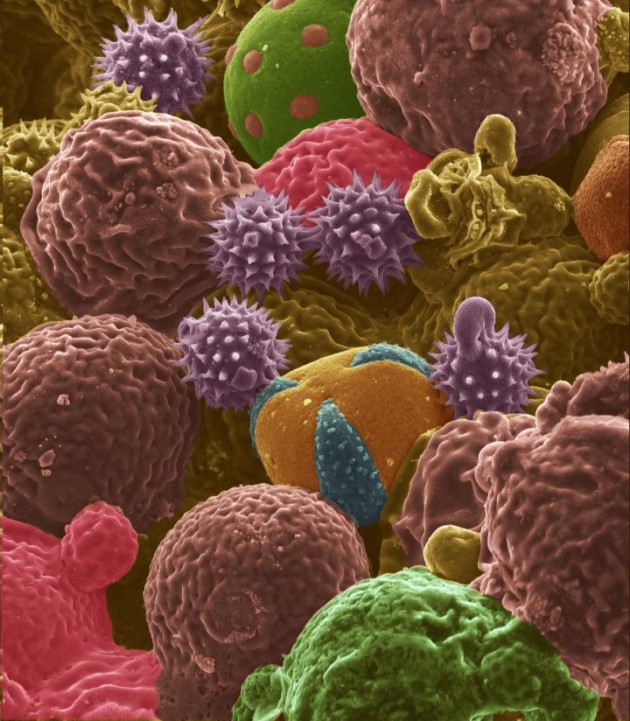
Des grains de pollen (ici en fausses couleurs) pourraient remplacer le graphite des batteries Lithium-ion (Crédit : Purdue University/Jialiang-Tang).
Depuis 1992, les batteries Lithium-ion ont alimenté successivement nos ordinateurs portables puis nos téléphones mobiles et enfin nos smartphones. Une technologie dont le très long règne pourrait bientôt s’achever, du moins dans sa forme classique : des chercheurs de l’université de Purdue, dans l’Indiana, ont montré que le pollen des massettes (Typha) pourrait venir doper les capacités de charge ce type de batterie.
Une découverte qui en outre permettrait de remplacer les matériaux non renouvelables des batteries, dont l’extraction est polluante, par une denrée, le pollen, qui se renouvelle à chaque saison…
Du pollen pour remplacer le graphite
Dans l’étude des chercheurs, c’est le remplacement graphite qui est visé. Ce minéral, dont on extrait plus d’un million de tonnes par an des roches métamorphiques, est une des formes naturelles (allotropes) du carbone pur – avec le diamant.
Il sert en particulier d’électrode pour batterie, soit l’un des dispositifs qui permet de générer du courant électrique à partir de réactions chimiques (décharge) ou au contraire de transformer l’électricité en énergie potentielle chimique (charge). Et c’est dans les électrodes que l’énergie d’une batterie est emmagasinée.
L’étendue de la surface des électrodes dicte la capacité de la batterie
Concrètement, dans une batterie Lithium-ion, l’électrode en graphite (dite anode) fait face à une électrode en dioxyde de cobalt et de lithium (dite cathode) : entre elles circulent des ions (molécules chargées) de lithium, comme le montre ce schéma :
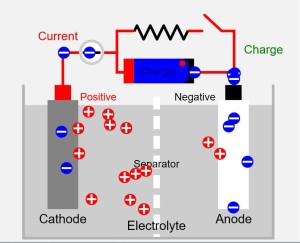
Schéma de fonctionnement d’une batterie : l’anode est en graphite, la cathode en dioxyde de cobalt et lithium. Pour générer un courant électrique (décharge), les ions lithium circulent de la cathode à l’anode en traversant un séparateur (Ph. Barrie Lawson CC BY-SA 3.0).
Or la capacité d’une batterie à emmagasiner de l’énergie dépend quasi-exclusivement de l’aptitude des électrodes à accumuler à leur surface des charges positives et négatives. Dit simplement, plus la surface des électrodes est étendue, plus la batterie peut emmagasiner de l’énergie. Et c’est là qu’entre en jeu le pollen…
L’atout du pollen : sa microstructure
En effet, les grains de pollen ont une microstructure qui maximise la surface exposée relativement à son volume : à cause de ses repliements, bourrelés et cavités, un mm² de sa “surface” (vue de loin) est en réalité bien plus étendue microscopiquement – de la même manière qu’un km de cotes bretonnes mesuré sur un plan à 1/10 000e contient beaucoup plus de métrage si on la mesure au sol, crique par crique, rocher par rocher.

Micrographies du pollen carbonisé : a) pollens divers transportés par les abeilles ; b) pollens de massette ; c) aspect de la surface du pollen de massette (Crédit : Purdue University).
Les chercheurs ont donc simplement eu l’idée d’agglomérer des grains de pollens de massette pour donner à l’ensemble la forme d’une électrode puis de “carboniser” cet agglomérat (par pyrolyse en atmosphère inerte) pour qu’il soit aussi pur que du graphite tout en gardant la microstructure de sa surface d’origine.
De très bonnes performances, surtout à haute température
Résultat : les tests des capacités d’accumulation d’énergie de cette électrode se sont révélées particulièrement encourageants, dépassant (de peu) celles du graphite à température ambiante, et présentant de plus hautes capacités à 50 °C – ce qui est particulièrement intéressant pour les appareils électroniques qui ont tendance à chauffer.
Néanmoins, avant de voir les batteries Lithium-ion classiques perdre leur monopole, il faudrait également réussir à augmenter les capacités de la cathode (en dioxyde de cobalt et lithium) car c’est l’électrode la moins efficace qui dicte la capacité globale d’une batterie.
–Román Ikonicoff
> Lire aussi :
- Une rose a été transformée en microprocesseur !
- On a découvert un matériau naturel capable de produire de l’énergie par photosynthèse
- Des microprocesseurs en bois, biodégradables, pour les ordinateurs de demain
> Lire également dans les Grandes Archives de Science & Vie :
- Voici les matériaux surnaturels – S&V n°1133 – 2012. Durant des millénaires, l’humanité s’est servie des matériaux offerts par la nature. Mais peu à peu, en apprenant à jouer sur leur composition d’abord, puis sur leur structure microscopique, nous sommes devenus des spécialistes de l’art de créer de nouveaux matériaux aux propriétés inédites.
- Gouttes, les voici utilisées pour créer des matériaux – S&V n°1149 – 2013. Les liquides peuvent aussi former des matériaux, notamment pour la médecine, du moment qu’on apprend à leur donner une structure – ce qui est désormais possible.
- ADN, les physiciens en font un matériau de construction – Depuis le début des années 2000, des physiciens se sont mis à inventer les “origamis” à base d’ADN, posant les bases de cette nanotechnologie très… biologique – S&V n°1113.